(Sie wünschen den folgenden Artikel als pdf-Datei? Schicken Sie einfach eine Mail mit Ihren Kontaktdaten und der Überschrift dieses Artikels an Kontakt@klaerwerk.info. Wir möchten gerne unsere Leser etwas kennenlernen und bitten deshalb um Angabe ihrer Kontaktdaten.)
1 Problemstellung
In den letzten Jahren hat sich der Einsatz von Kreide zur Säurekapazitätsanhebung auf Kläranlagen etabliert. Kreide zeigt im praktischen Einsatz deutliche Vorteile gegenüber den früher verwendeten genrannten Kalkprodukten. Es treten weder Inkrustierungen auf (z.B. beim Einsatz von Kreidesupensionen), noch gibt es Probleme mit dem Arbeitsschutz, da Kreide im Gegensatz zu Branntkalk nicht heiß wird und nicht wie Kalkhydrat einen hohen pH-Wert aufweist.
Kreide kann auch trocken in die Biologie gegeben werden (aus Bigbags, Säcken oder auch direkt aus dem LKW). Von Kreideablagerungen in Belebungsbecken wurde bisher nie berichtet, wenn die Kreide direkt in die Belebung gegeben wurde. Das Belebungsbecken ist daher die bevorzugte Zugabestelle.
Im Zuge der bundesweiten großtechnischen Anwendung hat sich gezeigt, dass die Kreide nicht nur hervorragend zur Säurekapazitätsanhebung geeignet ist (sofern Nitrifikanten im Belebtschlamm vorliegen), sondern auch erhebliche positive Auswirkungen auf die Belebtschlammflockenstruktur, die Zusammensetzung der Biozönose und die biologische Stabilität der Kläranlagen hat. Bei längerfristigem Kreideeinsatz rücken auch Fadenbakterienprobleme immer mehr in den Hintergrund.
Im Rahmen dieser Studie sollte untersucht werden, inwiefern die Zusammensetzung, die spezifische Oberfläche und die Korngrößenverteilung von Calciumcarbonaten sich speziell auf die Nitrifikanten (Ammonium- und Nitritoxidierer) und deren gewünschte Vergesellschaftung auswirkt. Dabei wurden auch die Ergebnisse unserer langjährigen Untersuchungen zum Einfluss von Kalksteinmehlen und Kreiden auf die Belebtschlammflockenstruktur mit einbezogen – dies mit dem Hintergrund, dass wir sehr häufig feststellen, dass Störungen des Nitrifikationsprozesses mit einer schlechten Belebtschlammflockenstruktur korrelieren.
2 Versuchsaufbau
2.1 Aufbau der Versuchsanordnung zur Untersuchung der Belebtschlammflockenstruktur beim Einsatz verschiedener Kalkprodukte
Für die geplanten Untersuchungen wurde ein Versuchsaufbau verwendet, der sich in den letzten Jahren für die verschiedensten Untersuchungen an Belebtschlamm bewährt hat, weil durch den Versuchsaufbau gewährleistet ist, dass alle 3 Versuchsbehälter
| • | genau gleich viel Sauerstoff bekommen, |
| • | genau gleich gefüttert werden, |
| • | genau gleich gerührt werden. |
Die Behälter werden normalerweise mit Belebtschlamm nach dem SBR-Verfahren betrieben. Das heißt, dass pro Tag in etwa 3 Zyklen abwechselnd Denitrifikations-, Nitrifikations- und Absetzphasen eingestellt werden.
Das Futter ist in der Regel eine Mischung aus Pepton, Fleischextrakt und Kaliumhydrogenphosphat. Die Zusammensetzung entspricht weitgehend dem üblicherweise in der Wissenschaft für Labor-Belebtschlammanlagen verwendeten, so genannten „künstlichen Abwassers“. Die Dosierung des gekühlten Futters erfolgt über eine hoch präzise Schlauchpumpe.
Die Umwälzung der Behälter (je 800 ml Nutzvolumen) erfolgt mittels baugleicher Labor-Flügelrührer. Der Antrieb der Rührer erfolgt über einen gemeinsamen Keilriemen, so dass alle 3 Behälter exakt mit der gleichen Geschwindigkeit gerührt werden.
Die Belüftung erfolgt über einen Kompressor, wobei die Luftmenge über einen selbst entwickelten und gebauten Luftverteiler und über sehr genau einstellbare Gasmengenmessgeräte gleichmäßig auf die 3 Behälter verteilt wird.
Die Reproduzierbarkeit der mit dem oben beschriebenen Aufbau erzielten Ergebnisse hat sich in den letzten 5 Jahren im Rahmen unzähliger (n>100), 1-3 wöchiger Versuchsreihen gezeigt.

Abbildung 1: „Standard-Versuchsaufbau“
2.2 Abänderung des Versuchsaufbaus für die vorliegenden Untersuchungen
Im Rahmen der hier dargestellten Versuchsreihe sollte untersucht werden, inwieweit sich Kreide im Vergleich zu Kalksteinmehl zur Säurekapazitätsanhebung, als Bewuchsfläche für Nitrifikanten und auch für andere Belebtschlammbakterien eignet.
Daher wurden die Versuche nicht mit Belebtschlamm durchgeführt, sonden mit jeweils 10 ml einer definierten Nitrifikantenkultur (Ammonium- und Nitritoxidierer; „Powerbakterien“ ) der Fa. Vermicon.
Pro Behälter wurden jeweils 3 g Kreide bzw. Kalksteinmehl mit 800 ml destilliertem Wasser aufgefüllt und mit einem stark ammoniumhaltigen Abwasser „gefüttert“. Die Behälter wurden 7-10 Tage lang betrieben und durchgehend belüftet.
Jeweils nach 4, 7 und 10 Tagen wurde kontrolliert, ob in allen 3 Behältern eine stabile Nitrifikation vorlag. Dafür wurden Ammonium, Nitrit, Nitrat, Ges-N, Wasserhärte und CSB im filtrierten Überstandswasser der zuvor abgesetzten Behälter gemessen (Hach Lange Küvettentests).
Nach Beendigung der jeweiligen Versuchsreihen wurden Proben des zentrifugierten Kalkschlamms an die Fa. Vermicon in München (Gensondenuntersuchungen) und an die Fa. Microscopy Services Dähnhardt GmbH in Flintbek geschickt.
3 Versuchsziel
Der hier beschriebene Versuch sollte zu folgenden Ergebnissen führen:
| 1. | In allen Behältern soll eine stabile Nitrifikation stattfinden. |
| 2. | Anzahl und Aktivität der Nitrifikanten (Ammonium- und Nitritoxidierer) nach Beendigung des Versuchs sollte mittels Gensonden untersucht werden. |
| 3. | Die Anordnung der Ammonium- und Nitritoxidierer zueinander sollte ebenfalls mit Hilfe der Gensonden beurteilt werden. Wünschenswert ist immer eine direkte „Nachbarschaft“ der beiden Gruppen, da die Nitritoxidierer die Endprodukte der Ammoniumoxidierer (Nitrit) weiter (zu Nitrat) verarbeiten. Ist die direkte Nachbarschaft nicht gegeben, ist der Nitrifikationsprozess insgesamt ineffizient und es kann z.B. zu Nitritanreicherungen im System kommen. |
| 4. | Mittels Rasterlektronenmikroskopaufnahmen der Kreide- bzw. Kalksteinmehlpartikel sollte deren Bakterienbesiedlung dokumentiert werden. |
| 5. | In der Zusammenfassung aller oben angegebenen Teilergebnisse sollte eine Beurteilung der getesteten Produkte hinsichtlich ihrer Eignung als Bewuchsfläche für Belebtschlammbakterien unter besonderer Berücksichtigung der nachbarschaftlichen Anordnung von Ammonium- und Nitritoxidierern möglich werden. |
3.1 Inhaltsstoffe der getesteten Produkte
Die untenstehende Tabelle zeigt, dass die beiden Kreideprodukte Optical 20 und Nitrifloc Aktiv deutlich weniger Calciumcarbonat enthalten als die beiden Kalksteinmehle. Beide Kreiden enthalten neben Calciumcarbonat auch ca. 8 Ma.-% Tonminerale, die sich nach unseren Erfahrungen sehr günstig auf die Förderung der Belebtschlammflockenstruktur auswirken. Das zeigen zahlreiche vergleichende Untersuchungen der Wirkung von Kalksteinmehlen und Optical 20 in unserem Hause, bei denen zumeist nach 1 Woche die Kalksteinmehle günstiger zu sein schienen, sich jedoch nach jeweils 2-3 Wochen das Optical 20 als das deutlich bessere Produkt für die Belebtschlammstruktur heraus stellte (vgl. Punkt 9). Dieses Ergebnis deckt sich mit unseren großtechnischen Erfahrungen, bei denen sich regelmäßig die ersten positiven Effekte des Kreideeinsatzes auf die Belebtschlamm-flockenstruktur nach ca. 3 Wochen zeigten.
| CaCO3 | MgCO3 | Tonminerale (Al2O3; Fe2O3, SiO2) | |
| Ma.-% | Ma.-% | Ma.-% | |
| Optical 20 | 91 | 1,0 | 8,0 |
| Nitrifloc Aktiv | 91 | 1,0 | 8,0 |
| Kalksteinmehl 1 | 98 | 1,0 | < 1 |
| Kalksteinmehl 2 | 98 | 1,0 | < 1 |
3.2 Schüttdichte, BET und Sieblinien
Die folgende Tabelle zeigt, dass die beiden getesteten Kreideprodukte eine wesentlich größere spezifische Oberfläche haben, als die beiden Kalksteinmehle. Bis auf Optical 20 haben alle Produkte ein Schüttgewicht von ca. 1 kg/l. Optical 20 ist wesentlich leichter und feiner als die übrigen Produkte:
| Produkt | Schüttdichte nach DIN EN 459-2 | BET Spezifische Oberfläche |
Siebrückstand | ||
| kg/l | m2/g | > 63 µm | > 90 µm | 100 % <... µm | |
| Optical 20 | 0,6 | 5-6 | 0 | 0 | 100 |
| Nitrifloc Aktiv | 1,0 | 5-6 | 21 | 10 | 150 |
| Kalksteinmehl 1 | ca. 1,0 | <1,0 | k.A.1) | k.A.1) | 125 |
| Kalksteinmehl 2 | ca. 1,0 | ca. 1,0 | k.A.1) | k.A.1) | 150 |
1) keine Angabe aus wettbewerbsrechtlichen Gründen
Die hohe Feinheit des Optical 20 trägt dazu bei, dass sich die Kreide bei Titrationsversuchen mit Salzsäure im Vergleich zu den anderen, gröberen Produkten am schnellsten auflöst. Das zeigt die folgende Grafik.
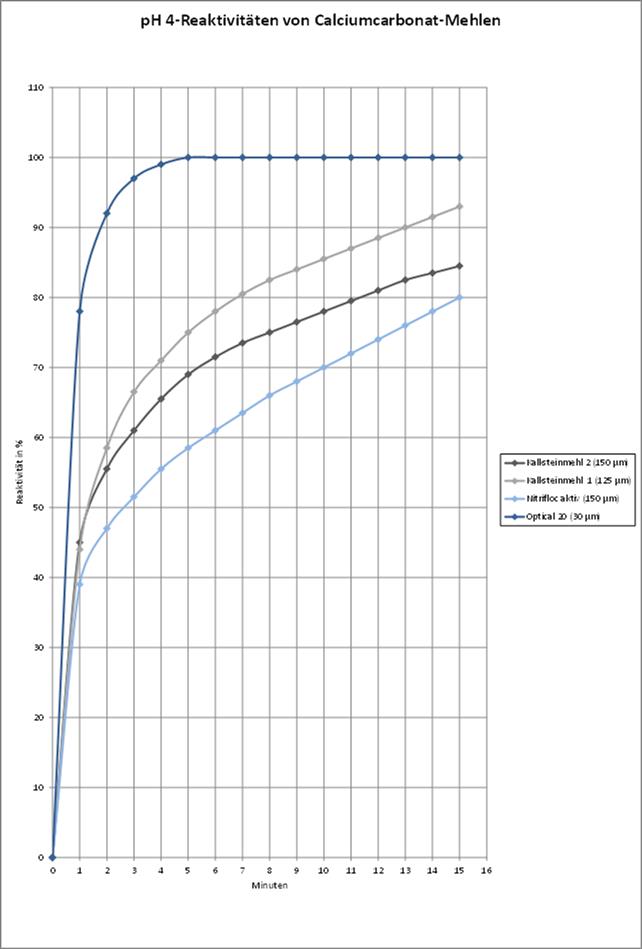
4 Säurekapazitätsanhebung
Wie erwartet hat die Feinheit des eingebrachten Produktes Auswirkungen auf die am Ende des Versuchs erzielte Wasserhärte gehabt. Je feiner das Produkt, umso höher die Calciumgehalte im Überstand nach Beendigung des Versuchs.
Die Säurekapazität im Überstand war jedoch bei den beiden gröberen Produkten Nitrifloc Aktiv und Kalksteinmehl 2 am höchsten. Die pH-Werte des Überstands ergaben keinen Zusammenhang mit der Feinheit des Produkts.
| Produkt | pH-Wert | Wasserhärte | Calcium | Magnesium | Säurekapazität |
| °dH | mg/l | mg/l | mmol/l | ||
| Optical 20 | 8,6 | 5,9 | 30,1 | 7,1 | 6,6 |
| Nitrifloc Aktiv | 8,7 | 4,0 | 20,4 | 5,2 | 10,3 |
| Kalksteinmehl 1 | 8,6 | 5,5 | 24,7 | 8,7 | 6,6 |
| Kalksteinmehl 2 | 8,5 | 4,5 | 19,1 | 7,9 | 9,9 |
5 Gensondenuntersuchungen
Mit Hilfe der Gensondenuntersuchungen der Kreiden bzw. Kalksteinmehle in den Bechergläsern nach 7-10 Tagen sollte festgestellt werden, ob sich leistungsfähige Ammonium- und Nitritoxidierer in ausreichender Zahl angesiedelt hatten und ob sich beide Gruppen in idealer Weise vergesellschaften konnten.
Es hat sich gezeigt, dass sich in allen Versuchsansätzen eine leistungsfähige Nitrifikantenkultur gebildet hat, sich jedoch auf den beiden gröberen Produkten (Kalksteinmehl 2 und Nitrifloc Aktiv) die höchste Bakteriendichte zeigte. Im Hinblick auf die gewünschte Vergesellschaftung der beiden Nitrifikantengruppen lag das Nitrifloc Aktiv weit vorne. Dieses Produkt hat neben einem relativ hohen Anteil größerer Partikel auch eine sehr hohe Oberfläche. Beides scheint gleichermaßen wichtig zu sein. Ist ein Produkt zu fein, löst es sich zu schnell auf, um hohe Nitrifikantenzahlen oder gar eine Vergesellschaftung der beiden Gruppen zu ermöglichen. Je größer die spezifische Oberfläche, desto größer die potentielle Besiedlungsfläche.
| Produkt | Prozentuale N-Eliminationsleistung | Ammoniumoxidierer (AOB) | Nitritoxidierer (NOB) | Vergesellschaftung |
| % | ||||
| Optical 20 | > 99 % | 2,0 – 2,5 | 1,5 – 2,0 | kaum |
| Nitrifloc Aktiv | > 99 % | 3,5 | 3,0 | deutlich |
| Kalksteinmehl 1 | > 99 % | 1,5 | 2,0 | nein |
| Kalksteinmehl 2 | > 99 % | 3,0 | 3,0 | beginnend |
Das folgende Foto zeigt einen mit Nitrifloc Aktiv behandelten Belebtschlamm, der bereits nach etwa 1 Woche auffällig viele Bakteriencluster aufweist. Diese Cluster sind Bakterien-Monokolonien, die bei Belebtschlamm entweder aus Nitrifikanten oder aus Bio-P-Bakterien bestehen. In Industriekläranlagen könnem die Cluster auch „Spezialbakterien“ enthalten, die sich von den schwer abbaubaren Bestandteilen im Abwasser ernähren und deren Verlust erhebliche Einbußen bezüglich der Reinigungsleistung nach sich ziehen würden.
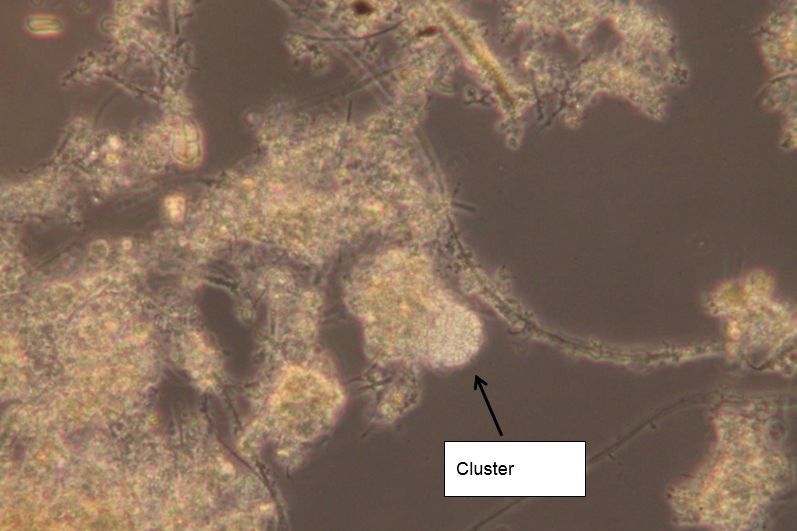
Abbildung 2: Bakteriencluster im Lebendpräparat (nach 1 Woche Nitrifloc Aktiv; 100-fach vergrößert)
Im Lebendpräparat ist es nicht möglich, die Bakterienart in den Clustern zu identifizieren. Das geht jedoch hervorragend mit Hilfe von Gensonden.
Die folgenden beiden Fotos zeigen einen identischen Ausschnitt einer Belebtschlammflocke im Phasenkontrast und unter Verwendung der Gensonde für Ammoniumoxidierer, die dann im Fluoreszenzmikroskop orange leuchten.
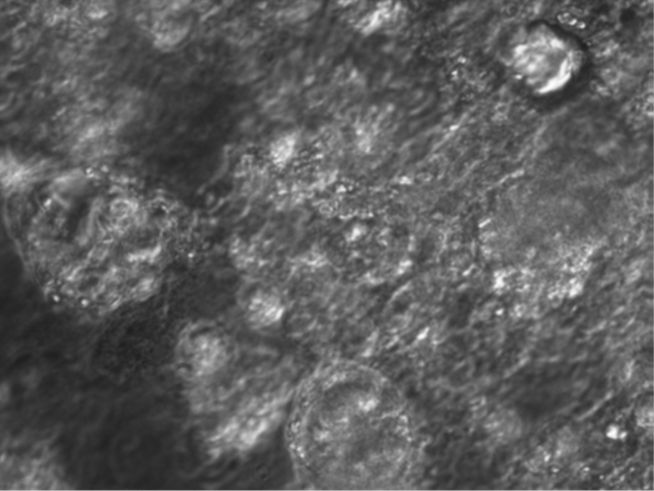
Abbildung 3: Belebtschlamm mit Nitrifloc Aktiv im Phasenkontrast (1000-fach vergrößert; Vermicon AG, München)
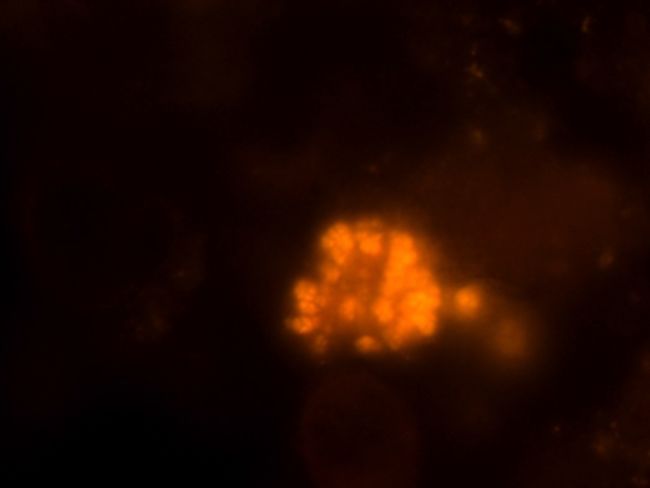
Abbildung 4: Identischer Ausschnitt mit Gensonden für Ammoniumoxidierer unter dem Fluoreszenzmikroskop (1000-fach vergrößert; Vermicon AG, München)
Grün leuchten dagegen die Nitritoxidierer, die auf den folgenden Fotos wiederum im Phasenkontrast und unter dem Fluoreszenzmikroskop fotografiert wurden:

Abbildung 5: Belebtschlamm mit Nitrifloc Aktiv im Phasenkontrast (1000-fach vergrößert; Vermicon AG, München)
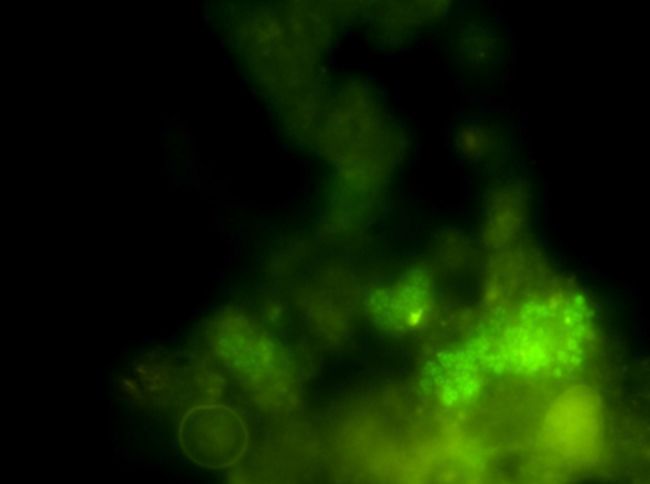
Abbildung 6: Identischer Ausschnitt mit Gensonden für Nitritoxidierer unter dem Fluoreszenzmikroskop (1000-fach vergrößert; Vermicon AG, München)
Im Hinblick auf die Vergesellschaftung der Ammonium- und Nitritoxidierer kam die Fa. Vermicon zu folgenden Aussagen:
| Produkt | VIT-Wert AOB | VIT-Wert NOB | Internes Ranking | Bemerkung |
| Optical 20 | 2,5 | 2,0 | 3 | AOB Tendenz zur Clusterbildung, kaum Vergesellschaftung von AOB und NOB-Clustern |
| Nitrifloc Aktiv | 3,5 | 3,5 | 1 | AOB Cluster vorhanden. NOB schöne Cluster, deutliche Vergesellschaftung |
| Kalksteinmehl 1 | 1,5 | 2,0 | 4 | AOB Einzelzellen, keine Vergesellschaftung von AOB und NOB-Clustern |
| Kalksteinmehl 2 | 3,0 | 3,0 | 2 | AOB sternförmige Anfangsclusterbildung, Vergesellschaftung tendenziell vorhanden |
Das Nitrifloc Aktiv fördert somit die gewünschte Vergesellschaftung der Ammonium- und Nitritoxidierer am besten. Das bedeutet dass der folgende Prozess
Ammonium → Nitrit → Nitrat (Nitrifikationsprozess)
sehr effizient ablaufen kann, weil die Nitritoxidierer das Endprodukt der Ammoniumoxidierer -das Nitrit also – direkt übernehmen und weiterverarbeiten können.
In der Praxis kann man
| • | schneller nitrifizieren (kürzere Belüftungszeiten), |
| • | bei niedrigeren Temperaturen nitrifizieren, |
| • | vollständiger nitrifizieren (es bleibt kein Nitrit „übrig“) und |
| • | die Nitrifikanten werden besser im System gehalten, weil sie auf den Nitrifloc-Aktiv-Partikeln sitzen und bei Streusalzeinsatz, Temperaturstürzen (Schneeschmelze) etc. nicht abtreiben. |
Neben der reinen Säurekapazitätsanhebung sind mit der Wahl des richtigen Produkts somit auch erhebliche positive Effekte auf die Wirtschaftlichkeit und Betriebsstabilität der Nitrifikation erreichbar.
6 Rasterelektronenmikroskop-Fotos
6.1 Optical 20
Auf dem Optical 20 wurde mit Hilfe der Gensonden eine mittlere Individuendichte an Nitrifikanten ohne signifikante Vergesellschaftung festgestellt.
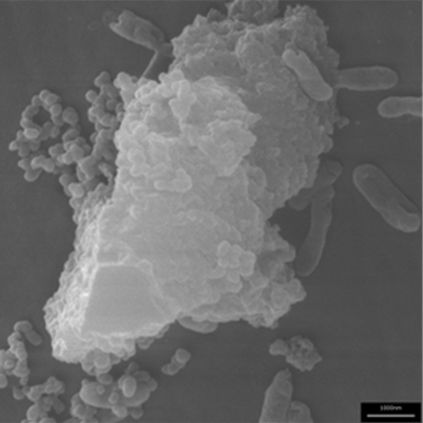
Abbildung 7: Optical 20 (Microscopy Services Dähnhardt, Flintbeck)
Abbildung 7 zeigt, dass sich der Bewuchs des Optical 20-Partikels in Grenzen hält. Die Bakterien sind eigentlich mehr an das Optical 20 Partikel „assoziiert“ (=angelagert). Eine ähnliche Assoziation zeigt Abbildung 8.
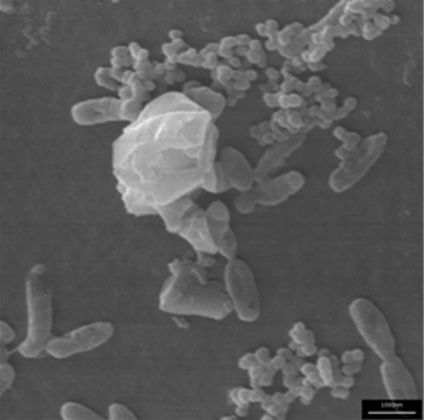
Abbildung 8: Optical 20 (Microscopy Services Dähnhardt, Flintbeck)
Abbildung 9 zeigt einen etwas stärkeren Bewuchs eines Optical 20-Partikels. Es handelt sich hier jedoch um ein relativ großes Teilchen.

Abbildung 9: Optical 20 (Microscopy Services Dähnhardt, Flintbeck)
6.2 Nitrifloc Aktiv
Die folgende Abbildung 10 zeigt einen sehr starken Bewuchs auf einem relativ kleinen Nitrifloc Aktiv-Partikel.

Abbildung 10: Nitrifloc Aktiv (Microscopy Services Dähnhardt, Flintbeck)
Abbildung 11 zeigt ein deutlich größeres Nitrifloc Aktiv-Partikel mit ebenfalls relativ starkem Bewuchs

Abbildung 11: Nitrifloc Aktiv (Microscopy Services Dähnhardt, Flintbeck)
Deutlich weniger Bewuchs zeigt sich auf der Abbildung 12, wo sich nur in der geschützten Krümmung des Partikels Bakterien angesiedelt haben. Die übrige Partikeloberfläche erscheint sehr glatt und ist nicht bewachsen.

Abbildung 12: Nitrifloc Aktiv (Microscopy Services Dähnhardt, Flintbeck)
Die folgenden beiden Abbildungen (Abbildung 13 und Abbildung 14) zeigen beide relativ kleine Partikel, wobei Abbildung 13 einen leichten Bewuchs aufweist, aber auch eine deutliche Assoziation angelagerter Bakterien, wohingegen Abbildung 14 ein kleines unbewachsenes Teilchen und ein kleines sehr stark bewachsenes Teilchen zeigt.

Abbildung 13: Nitrifloc Aktiv (Microscopy Services Dähnhardt, Flintbeck)

Abbildung 14: Nitrifloc Aktiv (Microscopy Services Dähnhardt, Flintbeck)
6.3 Kalksteinmehl 1
Die beiden nachfolgenden Fotos (Abbildung 15 und Abbildung 16) zeigen ein relativ kleines und ein relativ großes Körnchen Kalksteinmehl 1, die beide einen vergleichsweise geringen Bakterienaufwuchs zeigen.

Abbildung 15: Kalksteinmehl 1 (Microscopy Services Dähnhardt, Flintbeck)

Abbildung 16: Kalksteinmehl 1 (Microscopy Services Dähnhardt, Flintbeck)
6.4 Kalksteinmehl 2
Abbildung 17 und 18 zeigen ein relativ kleines und ein relativ großes Körnchen Kalksteinmehl 2, die beide einen vergleichsweise geringen Bakterienaufwuchs zeigen. Deutlich sind die Furchen von der Vermahlung erkennbar.

Abbildung 17: Kalksteinmehl 2 (Microscopy Services Dähnhardt, Flintbeck)

Abbildung 18: Kalksteinmehl 2 (Microscopy Services Dähnhardt, Flintbeck)
Zusammenfassung
Die hier vorgestellten Ergebnisse lassen folgende Schlüsse zu:
| • | Alle getesteten Produkte sind für die Säurekapazitätsstützung gleichermaßen geeignet. |
| • | Die Vergesellschaftung von Nitrifikanten funktioniert bei Produkten mit einem höheren Anteil an größeren Partikeln besser. Der Grund dafür ist sehr wahrscheinlich die vergleichsweise höhere Verweilzeit der größeren Partikel im System. Die Vergesellschaftung der beiden Nitrifikantengruppen dauert offensichtlich ein paar Tage. Am besten hat das Nitrifloc aktiv abgeschnitten. |
| • | Der hohe Anteil an Tonmineralien befördert offensichtlich die Assoziation von Bakterien an die Kreidepartikel. Daher wirken die tonmineralhaltigen Kreiden ab einer Versuchsdauer von 10 Tagen deutlich besser auf die Flockenbildung als die Produkte ohne Tonmineralien. |
| • | Die Bakterien bevorzugen beim Bewachsen Furchen und Nischen in den Produktpartikeln. Glatte Flächen werden kaum bewachsen. Somit ist die Annahme, dass eine hohe BET-Oberfläche günstig für die Eignung eines Kreideprodukts als „Bewuchsfläche“ sein müsste, offensichtlich richtig. |
Unser Dank gilt Herrn Dähnhardt von der Fa. Microscopy-Services Dähnhardt (Flintbeck) für die Erstellung der REM-Aufnahmen und Frau Dr. Beimfohr von der Fa. Vermicon AG (München) für die Stellung der Nitrifikanten (Power Bakterien) und die Gensondenuntersuchungen. Beide Firmen haben bei dieser Untersuchung Neuland beschritten und uns hervorragend beraten.
Anschrift des Verfassers:
Kirsten Sölter
Bioserve GmbH
Rheinhessenstraße 9a
55129 Mainz
Tel.: 06131-28 910-16
Fax: 06131-28 910-17
E-Mail: Soelter@bioserve-gmbh.de
